乙酸乙酯的制備儀器裝置圖
一、實驗原理
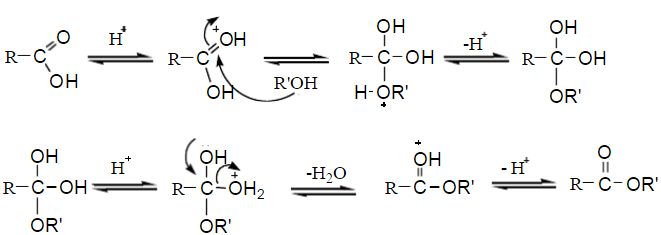
在少量酸(H2SO4或HCl)催化下,羧酸和醇反應生成酯,這個反應叫做酯化反應(Esterification)。該反應通過加成-消去過程。質子活化的羰基被親核的醇進攻發生加成,在酸作用下脫水成酯。該反應為可逆反應,為了完成反應一般采用大量過量的反應試劑(根據反應物的價格,過量酸或過量醇)。有時可以加入與水恒沸的物質不斷從反應體系中帶出水移動平衡(即減小產物的濃度)。在實驗室中也可以采用常用實驗耗材中的分水器來完成。
酯化反應的可能歷程為:
乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物與乙醇反應制取,也可由乙酸鈉與鹵乙烷反應來合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用濃硫酸、氯化氫、對甲苯磺酸或強酸性陽離子交換樹脂等作催化劑。若用濃硫酸作催化劑,其用量是醇的3%即可。其反應為:
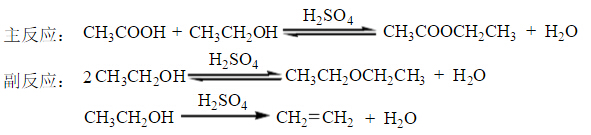
酯化反應為可逆反應,提高產率的措施為:一方面加入過量的乙醇,另一方面在反應過程中不斷蒸出生成的產物和水,促進平衡向生成酯的方向移動。但是,酯和水或乙醇的共沸物沸點與乙醇接近,為了能蒸出生成的酯和水,又盡量使乙醇少蒸出來,本實驗采用了較長的分餾柱進行分餾。
二、實驗儀器及所需藥品
儀器:恒壓漏斗、三口圓底燒瓶、溫度計、刺形分餾柱、蒸餾頭、直形冷凝管、接引管和錐形瓶。
藥品:冰醋酸、95%乙醇、濃硫酸、飽和碳酸鈉溶液、飽和食鹽水、飽和氯化鈣溶液、
無水碳酸鉀。
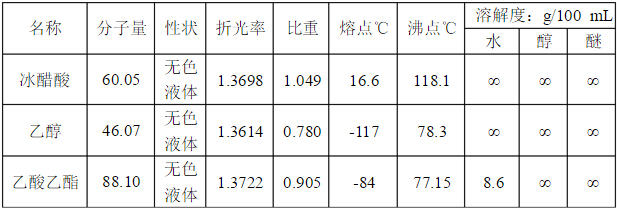
三、主要試劑及產品的物理常數(文獻值)
四、實驗裝置圖

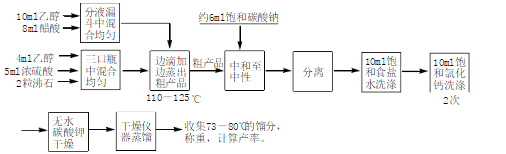
五、實驗流程圖
六、實驗步驟
1、反應
在100 mL三口燒瓶中的一側口裝配一恒壓滴液漏斗,滴液漏斗的下端通過一橡皮管連接一J形玻璃管,伸到三口燒瓶內離瓶底約3 mm處,另一側口固定一個溫度計,中口裝配一分餾柱、蒸餾頭、溫度計及直型冷凝管。冷凝管的末對端連接接引管及錐形瓶,錐形瓶用冰水浴冷卻。
在一小錐形瓶中放入3 mL乙醇,一邊搖動,一邊慢慢加入3 mL濃硫酸,并將此溶液倒入三口燒瓶中。配制15.5 mL乙醇和14.3 mL冰醋酸的混合溶液倒入滴液漏斗中。用油浴加熱燒瓶,保持油浴溫度在140℃左右,反應體系溫度約為120℃左右。然后把滴液漏斗中的混合溶液慢慢滴加到三口燒瓶中。調節加料的速度,使和酯蒸出的速度大致相等。加料約90 min。這時保持反應物溫度120~125℃。滴加完畢后,繼續加熱約10 min,直到不在有液體流出為止
2、純化
反應完畢后,將飽和碳酸鈉很緩慢地加入餾出液中,直到無二氧化碳氣體逸出為止。飽和碳酸鈉溶液要小量分批地加入,并要不斷地搖動接收器(為什么?)。把混合液倒入分液漏斗鐘,靜置,放出下面的水層。用石蕊試紙檢酯層。如果酯層仍顯酸性,再用飽和然酸鈉溶液洗滌,直到酯層不顯酸性為止。用等體積的飽和食鹽水洗滌(為什么?)。放出下層廢液。從分液漏斗上口將乙酸乙酯倒入干燥的小錐形瓶內,加入無水碳酸鉀干燥。放置約20min,在此期間要間歇震蕩錐形瓶。
把干燥的粗乙酸乙酯濾入50mL燒瓶中。裝配蒸餾裝置,在水浴上加熱蒸餾,收集74~80℃的餾分。
產量:14.5~16.5g
注意:
1、由于乙酸乙酯可以與水、醇形成二元、三元共沸物,因此在餾出液中還有水、乙醇;
2、在此用飽和NaCl溶液的目的是降低乙酸乙酯在水中的溶解度;
3、蒸餾:將干燥好的粗乙酸乙酯轉移置50 mL的單口燒瓶中,水浴加熱,常壓蒸餾,收集74~84℃餾分。稱重并計算產率;
4、干燥劑無水碳酸鉀也可用無水硫酸鎂替代;
5、也可在石棉網上加熱,控制反應溫度在120~125℃,溫度過高會增加副產物乙醚的含量;
6、控制濃硫酸滴加的速度太快,則會因局部放出大量的熱量而引起爆沸;
7、洗滌時注意放氣,有機層用飽和NaCl溶液洗滌后,盡量將水相分干凈;
上一篇:西安高純試劑哪家有?