為什么氯氣、氨氣容易液化? 各種氣態物質分子間的作用力不同,它們液化的難易也不一樣,水在101KPa下低于100℃時就能液化,而要使氯氣在室溫下液化就必須加壓才行。氫氣和氧氣則在室溫下無論加多大壓力都不能使它們液化。須將溫度分別降到-239.8℃和-119℃時它們才能液化。
每種氣體都有一個特定的溫度,在這個溫度以上,不論加多么大的壓力都不能使其液化,這個特定溫度就叫氣體的臨界溫度。在臨界溫度時,使氣體液化所需的最低壓力叫臨界壓力。
下表列出某些氣體的臨界溫度和臨界壓力。
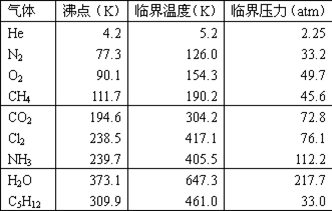
為什么氯氣、氨氣容易液化? 從表中數據可以看出,氣體沸點越低,其臨界溫度也越低,它就越難液化。氦氣是最難液化的氣體。在室溫下不能加壓液化的He、N2、O2、CH4等稱為“永久氣體”。沸點低而臨界溫度高于室溫的CO2、Cl2、NH3等在室溫下加壓就能液化,它們稱為“可凝聚氣體”。沸點和臨界溫度均高于室溫的C5H12和H2O等,在常溫常壓下就是液體了。
為什么氯氣、氨氣容易液化? 為什么在臨界溫度以上無論加怎樣大的壓力都不能使氣體液化呢?這是因為氣體分子熱運動引起的擴散膨脹因素只決定于溫度,而與壓力無關。溫度高,分子熱運動快,由熱運動引起的擴散膨脹因素也明顯,此時盡管加壓可使分子間距離縮小,吸引力增大,但這種縮小不是無限制的。如加壓使分子間距離縮到最小產生的引力尚不足以克服分子運動引起的擴散膨脹,那么氣體仍不能液化,只有降溫和加壓同時采用,液化才有可能。
上一篇:易變質試劑及保存方法
下一篇:濃硫酸溶于水是物理變化嗎?


